一烧杯中盛有100mL2mol·L-1的H2SO4溶液,有一表面光滑的塑料小球悬浮于溶液中央(如下图所示),向该烧杯里缓缓注入0.4mol·L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中:
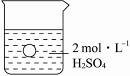
(1)烧杯里观察到的实验现象有:
① 。
② 。
(2)写出实验过程中反应的离子方程式: 。
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
(1)写出元素符号:A_________;B______;C_________。
(2)C的原子结构示意图:____;B的最高价氧化物对应水化物的化学式为_______。
(3)A的氢化物的水溶液显____(填酸或碱)性。
有:①11H、21H、31H ②H2、D2、T2③石墨、金刚石④正丁烷和异丁烷四组微粒或物质,回答下列问题:(填序号)
(1)互为同素异形体的是_______;(2)互为同分异构体的是__________
按要求填写
(1)元素所在的周期序数=;主族元素所在的族序数=;
(2)写出最活泼的非金属元素在周期表中的位置___________
(3)指出下列过程中的能量转化形式
①高温分解水②甲烷的燃烧
(4)在一定温度下,1molCO气体与1mol水蒸气在催化剂存在下完全反应,生成CO2气体和氢气,放热41kJ的热化学方程式为:
__________________________________________________________________
在溶液中,反应A+2B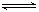 C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为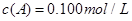 、
、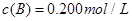 及
及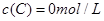 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。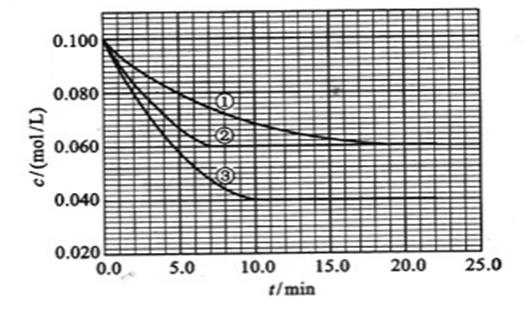
(1)与①比较,②和③分别仅改变一种反应条件。
所改变的条件是:②_______________;③_______________;
(2)实验②平衡时B的转化率为_________;
实验③化学平衡常数____________;(取三位有效数字)
(3)该反应的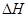 _________0,判断其理由是__________ __
_________0,判断其理由是__________ __
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)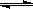 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)