设计一个只用BaCl2溶液及试管鉴别Na2SO3溶液和稀硫酸的实验,简要写出鉴别过程。
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式: __________________________、
_________________________________。
(2)根据甲同学设计的实验及现象不能证明是乙炔与溴发生了加成反应,其理由是 _______
(a)使溴水褪色的反应,未必是加成反应(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是,它与溴水反应的离子方程式是;在验证过程中必须全部除去。
(4)为验证此反应是加成而不是取代,丙同学用pH试纸来测试反应后溶液的酸性,理由是。
实验是化学的基础。下图为一化学实验装置图,图中,夹持仪器已略去,用“△”表示用酒精灯加热。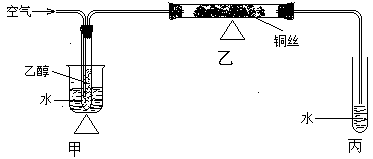
请仔细观察该实验装置图,回答问题:
(1)甲装置通入空气的导气管插入乙醇中的主要目的是
(2)乙装置用揉乱的铜丝,好处是
(3)乙装置的化学反应反应方程式为,反应中,转移电子的数目是若有23g乙醇发生反应,至少需要通入标准状况下的空气L
(4)写出一种检验反应产物的方法及现象
(5)该反应还可以用更简便的方法实现:取一束铜丝在酒精灯上加热,铜丝变黑,趁热插入盛有少量乙醇的试管中,铜丝又变红;如此反复多次即可。请写出实验中发生反应的化学方程式。
某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:
SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
(1)上述实验需要加热的装置是
(2)D中,烧杯盛放的是
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式 ________________
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入 ________ 溶液,现象是
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是
A.关闭K2开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为 ________
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下: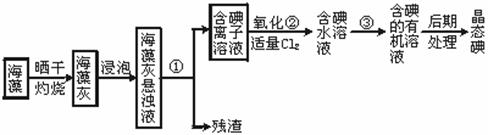
(1)指出提取碘的过程中有关实验操作名称 ①③
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
| A.乙酸 | B.苯 | C.四氯化碳 | D.酒精 |
| 有机试剂 |
酒精 |
四氯化碳 |
苯 |
乙酸 |
| 毒性 |
无 |
无 |
有 |
无 |
| 水溶性 |
与水以任意比互溶 |
与水互不相溶 |
与水互不相溶 |
与水以任意比互溶 |
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: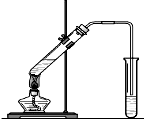
⑴装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
⑵该反应属于哪类反应类型。
| A.加成反应 | B.取代反应 | C.水解反应 | D.酯化反应 |
⑶反应中浓硫酸的作用是:
⑷写出制取乙酸乙酯的化学反应方程式: