某溶液中可能含有Cl-、I-、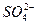 、
、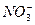 、
、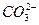 、
、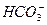 ,现进行如下实验:
,现进行如下实验:
(1)取部分溶液,加入过量Ba(NO3)2溶液,有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3,并放出气体。
(2)取部分滤液,加入过量NaOH溶液,无沉淀产生。
(3)取部分滤液,加入AgNO3溶液,只有黄色沉淀生成。
根据上述现象,试判断:溶液中肯定存在的离子是____________,肯定不存在的离子是____________,可能存在的离子是____________。
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。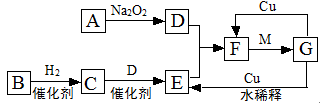
(1)物质G的化学式:。
(2)物质B的电子式:。
(3)写出C→E的化学方程式:;
(4)G→F的离子方程式:。
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂b.降低反应温度
c.增大体系压强d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。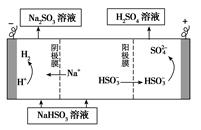
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 |
H—H |
N—H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为:。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:。
根据要求填空:
(1)只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120˚,一根单键和一根三键之间的夹角为180˚,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其他杂原子及与杂原子相连的氢原子须保留。每个端点和拐角处都代表一个碳。用这种方式表示的结构式为键线式。写出下列有机物的键线式:
①CH3(CH2)2COOH____________________;②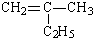 :__________________。
:__________________。
(2)写出下列原子团的电子式:①甲基 _______________;②氢氧根离子 _____________
(3)写出有机物 的名称 _______________________________________
的名称 _______________________________________
(4)在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”.C7H16的同分异构体中具有“手性碳原子”的有 ___________种.
(5)某有机高分子化合物的结构片段如下:
则合成它的单体是 ____________________________________。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下: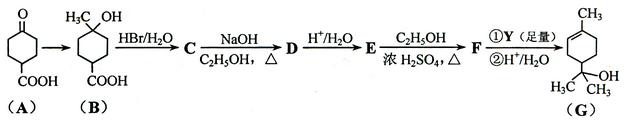
已知:RCOOC2H5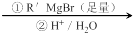
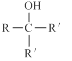
请回答下列问题:
(1)A所含官能团的名称是________________。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
_______________________________________________________________。
(3)B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
① 核磁共振氢谱有2个吸收峰② 能发生银镜反应
(4) B → C、E → F的反应类型分别为_____________、_____________。
(5)C → D的化学方程式为____________________________________________。
(6)试剂Y的结构简式为______________________。
(7)通过常温下的反应,区别E、F和G的试剂是______________和_____________。
(8)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。