依据下列条件能将某溶液的物质的量浓度计算出来的是()
①每10 mL溶液中含有0.23 g Na+的硫酸钠溶液
②每10个水分子中溶有1个Na+的NaOH溶液
③浓度为18.4 mol·L-1的硫酸10 mL加到100 mL水中所得的稀硫酸
④标准状况下,100 mL氨气溶于20 mL水中所得溶液的密度为0.9 g·cm-3的氨水
| A.①② | B.①③ |
| C.①④ | D.②③ |
根据下列实验操作及现象,能得出相应结论的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
①向溶液中通入CO2, ②继续通入CO2至过量 |
①溶液变浑浊 ②浑浊不消失 |
原溶液一定是NaAlO2溶液 |
| B |
①向溶液中加入KSCN溶液,②滴入一定量盐酸 |
①溶液无明显现象 ②溶液变为血红色 |
原溶液中可能含有Fe2+、NO3- |
| C |
用洁净铂丝蘸取少量溶液进行焰色反应 |
火焰呈黄色 |
原溶液一定是钠盐溶液 |
| D |
向溶液中加入盐酸 |
产生的气体使澄清石灰水变浑浊 |
原溶液中一定含有CO32- |
W、X、Y、Z是核外电子层数相同且原子序数依次增大的短周期元素,W、X是金属元素,Y的氢化物为H2Y,Z的某种含氧酸有漂白性。W、X的最高价氧化物对应的水化物可以发生反应生成盐和水。下列判断正确的是
| A.X的金属性强于W的金属性 |
| B.W、X分别与Z形成的化合物都是离子化合物 |
| C.W、X、Y、Z的简单离子的半径:Y>Z>W>X |
| D.Y的氧化物通入含有Z单质的溶液中,一定无明显变化 |
下列离子组在一定条件下能大量共存,且加入试剂后发生反应的离子方程式正确的是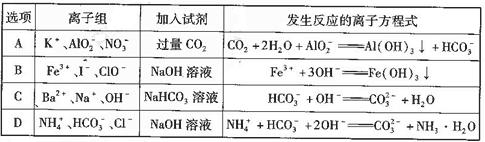
关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
| A.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
| B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
C.已知25℃时,Ksp[Fe(OH)3]=4.0×10—38,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=4.0×104 Fe3++3H2O的平衡常数K=4.0×104 |
| D.已知25℃时,Ksp[Mg(OH)2]=1.8×10—11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)=1.8×10-5mol·L—1 |
有机化学中化合物的结构可用键线式表示,如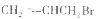 可表示为
可表示为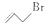 。则有机物
。则有机物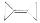 的二氯代物有
的二氯代物有
| A.2种 | B.3种 | C.4种 | D.5种 |