设NA为阿伏加德罗常数,下列关于0.2 mol·L-1Ba(NO3)2溶液的叙述不正确的是( )
| A.2 L溶液中阴、阳离子总数为0.8 NA |
B.500 mL溶液中 离子浓度为0.2 mol·L-1 离子浓度为0.2 mol·L-1 |
| C.500 mL溶液中Ba2+离子浓度为0.2 mol·L-1 |
D.500 mL溶液中 离子浓度为0.2 NA 离子浓度为0.2 NA |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
| C.由C(石墨)= C(金刚石);△H=" +1.90" kJ/mol可知,金刚石比石墨稳定 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:
2SO2+O2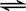 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能小于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能小于n的是
| A.2 mol SO2+ 1 mol O2 |
| B.4 mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2mol SO3 |
| D.3 mol SO2+ 1 mol O2+ 1 molSO3 |
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
| A.氯化铁 | B.亚硫酸钠 | C.硫酸镁 | D.碳酸氢铵 |
50mL的酸式滴定管中盛有0.1mol/L的HCl溶液,溶液的凹液面最低点刻度为20.00mL。若将滴定管内的酸液全部放完,刚好中和锥形瓶内30.00mL的NaOH溶液,此碱液的浓度为
| A.>0.1mol/L | B.<0.1mol/L | C.=0.1mol/L | D.不能确定 |
25℃时四种水溶液①HCl ②NH4Cl ③KOH ④Na2CO3的 pH依次为4、4、10、10,则溶液中水的电离程度大小关系正确的是
| A.①=②=③=④ | B.①>③>②>④ |
| C.④=②>③=① | D.①=③>②=④ |