下列关于配制一定体积一定物质的量浓度溶液的说法正确的组合是( )
①托盘天平可记录到小数点后一位,滴定管和容量瓶可记录到小数点后两位。
②托盘天平只能粗略地称量物质的质量,量筒只能粗略地量取液体的体积,严格地说,它们都不能与容量瓶——精确仪器配套使用。
③量筒内的残液必须冲洗下来,转移入容量瓶中。
④称量的固体(或量取的液体)可直接放入容量瓶中溶解(或稀释)。
⑤引流时,玻璃棒不能靠在瓶口上。
⑥定容摇匀后,若液面低于刻度线,可再次加水补齐。
| A.①②⑤ | B.①③④ | C.②④⑥ | D.④⑤⑥ |
关于吸热反应的说法正确的是( )。
| A.凡需加热的反应一定是吸热反应 |
| B.只有分解反应才是吸热反应 |
| C.使用催化剂的反应是吸热反应 |
| D.若CO2与CaO化合是放热反应,则 CaCO3分解是吸热反应 |
砹是第七主族第六周期的元素,推测砹或砹的化合物最不可能有的性质是()。
| A.HAt很稳定 | B.砹易溶于某些有机溶剂 |
| C.AgAt不溶于水 | D.砹是有色固体 |
下列各组物质中,含有相同的化学键的是()
| A.HI和NaI | B.H2S和SO2 | C.Cl2和KCl | D.F2和NaBr |
下列变化的比较, 不正确的是()。
| A.酸性强弱: HClO4> H2SO4> H3PO4> H4SiO4 | B.原子半径大小: Na > S > O |
| C.碱性强弱: KOH > NaOH > LiOH | D.还原性强弱: F-> Cl-> I- |
据报导我国最近合成多种元素的新同位素,其中一种是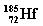 (铪),它的中子数是()
(铪),它的中子数是()
| A.72 | B.113 | C.185 | D.257 |