相对分子质量为M的某物质在室温下的溶解度为s g/100 g水,此时测得饱和溶液的密度为d g·cm-3,则该饱和溶液的物质的量浓度为( )
A. mol·L-1 mol·L-1 |
B.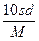 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D. mol·L-1 mol·L-1 |
把晶体丙氨酸溶于水,加入NaOH使溶液呈现强碱性,则下列四种微粒中,存在最多的是

A.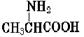 |
B.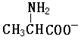 |
C.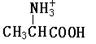 |
D.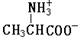 |
设NA为阿伏加德罗常数的值,下列说法正确的是()
| A.1mol H2O2中含极性共价键数为NA,含非极性共价键数为2NA |
| B.1mol固体Na218O2与足量CO2反应后,固体质量增重28g |
| C.S2和S8的混合物共6.4g,其中所含硫原子数为0.2NA |
| D.60gSiO2中含Si—O键的个数为2 NA |
下列各项实验操作正确的是
| A.使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B.为增强高锰酸钾溶液的氧化性,可用盐酸将高锰酸钾溶液酸化 |
| C.将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D.在测定盐酸和氢氧化钠溶液反应的中和热时,氢氧化钠溶液应过量 |
下列离子方程式书写正确的是
| A.溴乙烷与6mol/L的氢氧化钠水溶液共热: C2H5Br+OH- 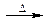 CH2=CH2↑+Br-+H2O CH2=CH2↑+Br-+H2O |
| B.等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合: Ca2++2HCO3-+2OH-  CaCO3↓+CO32-+2H2O CaCO3↓+CO32-+2H2O |
| C.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入1~2滴盐酸: 3Fe2++4H++NO3-  3Fe3++NO↑+2H2O 3Fe3++NO↑+2H2O |
D.在H2O2中加入酸性高锰酸钾溶液:2MnO4-+6H++5H2O2 2Mn2++5O2↑+8H2O 2Mn2++5O2↑+8H2O |
根据相关化学原理,下列判断正确的是()
A.若X是原子晶体,Y是分子晶体,则熔点:X>Y
B.若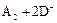 ═
═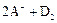 ,则氧化性:D2>A2
,则氧化性:D2>A2
C.若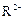 和
和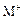 的电子层结构相同,则原子序数:R<M,离子半径:
的电子层结构相同,则原子序数:R<M,离子半径: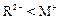
D.若弱酸HA、HB的酸性HA>HB,则溶液的碱性NaA>NaB