配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度标线,这时应采取的措施是( )
| A.倾出标线以上的液体 | B.立即吸出标线以上的溶液 |
| C.影响不大,不再处理 | D.重新配制 |
【原创】下列叙述正确的是
| A.37Cl2含有40个中子 |
| B.在一定的条件下,1摩尔氮气和3摩尔氢气反应能生成2摩尔氨气 |
| C.增大压强,反应速率一定加快 |
| D.放热反应肯定不需要加热就能反应 |
【原创】实验室用3.0 mol·L-1的硫酸溶液与锌粒反应制取氢气。下列措施中可能加大反应速率的是
| A.适当降低温度 |
| B.将锌粒改为锌粉 |
| C.将所用硫酸换成98%的浓硫酸 |
| D.加入少量醋酸钠固体 |
铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是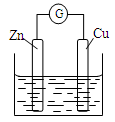
| A.铜电极上发生还原反应 |
| B.锌电极是原电池的负极 |
| C.电子从铜极经过外电路流向锌极 |
| D.锌电极上的反应为Zn-2e— ="=" Zn2+ |
【改编】以下各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.BCl3 | C.SO2 | D.PCl3 |
钴制是非常广泛的放射源,在医疗上常肺癌和肿瘤放射治疗。有关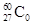 的说法中正确的是
的说法中正确的是
| A.质量数为27 | B.质子数为60 | C.中子数为33 | D.核电荷数为33 |