在如下图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
4 mol·L-1NaOH溶液 |
| C |
Cl2 |
饱和NaCl水溶液 |
| D |
NH3 |
1 mol·L-1盐酸 |
我国首创的海水电池以铝为负极,铂网为正极,海水为电解质溶液。空气中的氧气与铝反应产生电流,电池总反应为:4Al + 3O2+ 6H2O=4Al (OH )3,下列说法正确的是()
| A.电池工作时,电流由铝电极沿导线流向铂电极 |
| B.以网状的铂为正极,可增大与氧气的接触面积 |
| C.为了增加海水的导电性,向海水中加人大量食盐 |
| D.负极反应:O2+ 2H2O+ 4e-=4OH一 |
对于反应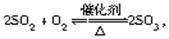 下列判断正确的是( )
下列判断正确的是( )
| A.2 mol SO2和足量的O2反应,必生成2 mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度必为O2浓度的2倍 |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.四种元素的单质中,Z单质的熔沸点最高 |
| D.X的单质能与H2反应,生成一种弱酸性的物质 |
已知N2(g)+3H2(g)==2NH3(g) △H=-92 kJ·mol-1。且1 mol N≡N键完全断裂时吸收热量946 kJ, 1 mol H-N键形成时放出热量391 kJ,则氢气中1mol H-H键断裂时吸收热量为()
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是 ( )
| A.V(NH3)="0.5" mol •L-1•min-1 | B.V(H2)="0.3" mol •L-1•min-1 |
| C.V(N2)="0.2" mol •L-1•min-1 | D.V(H2)="0.01" mol •L-1• s -1 |