Ⅰ.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途_________________________________。
Ⅱ.实验室制备氨气,下列方法中适宜选用的是__________________。
①固态氯化铵加热分解
②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热
④固态氯化铵与氧化钙混合加热
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图119中夹持装置均已略去)。
图1-9
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
完成下列问题:
(1)检验氢气纯度的目的是___________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是__________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是___________________________,C瓶内气体的成分是_________。
(3)在步骤③中,先加热铁触媒的原因是____________________________________。反应管E中发生反应的化学方程式是___________________________。
利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
| ⑴ |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| ⑵ |
 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| ⑶ |
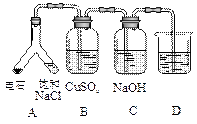 |
实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
| ⑷ |
 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的质量分数为(保留2位小数,气体的体积已折算成标准状况)。 |
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答: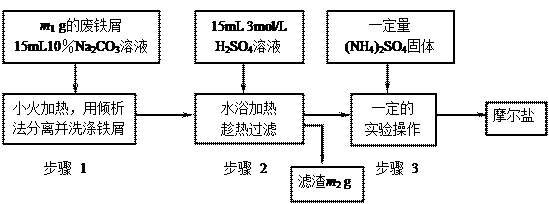
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示):▲。步骤2中溶液趁热过滤的原因是 ▲。
中铁屑过量的目的是(用离子方程式表示):▲。步骤2中溶液趁热过滤的原因是 ▲。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲时,停止加热。需经过的实验操作包括: ▲、 ▲ 、减压过滤(或抽滤)等得到较为 ▲的晶体。
加热到 ▲时,停止加热。需经过的实验操作包括: ▲、 ▲ 、减压过滤(或抽滤)等得到较为 ▲的晶体。
(5)抽滤装置的仪器有: ▲、 ▲、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++MnO4-+( )="" Mn2++Fe3++H2O
②本实验的指示剂 ▲。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲。
⑤产品中Fe2+的质量分数为 ▲。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲。(用a,b,c回答)
实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出)。请回答有关问题: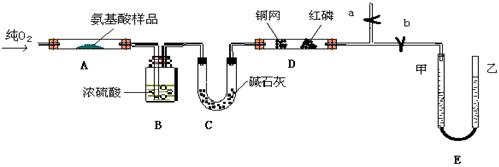
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的
目的是,之后关闭止水夹a。
(2)由装置B、C可分别确定待测氨基酸中含有的和质量。
(3)E装置的作用是测量的体积,并由此确定待测氨基酸中含有的
的质量,为了较准确地测量该气体的体积。在读反应前后甲管中液面的读数求其差值
的过程中,应注意(填代号)。
a、视线与凹液面最低处相平 b、等待片刻,待乙管中液面不再上升时,立刻读数
c、读数时应上下移动乙管,使甲、乙两管液面相平
d、读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确
其理由是
(5)严格地说,按上述方案只能确定氨基酸的。
若要确定此氨基酸的分子式,还要测定该氨基酸的。
某学生做浓度对化学反应速率的影响实验时,将3支试管编号为①②③,并按下表中的物质的量进行实验,记录的时间数据是16s、28s、33s。请将3个时间数据填入下表的适当位置,并写出实验结论。
| 试管编号 |
加3%Na2S2O3溶液/ml |
加H2O/ml |
加H2SO4(1:5)/滴 |
出现浑浊所用时间/s |
| ① |
3[ |
3 |
5 |
a |
| ② |
4 |
2 |
5[] |
b |
| ③ |
5 |
1 |
5 |
c |
(1) a=、b=、 c=
(2)实验结论:
(3)写出反应的化学方程式: [来源:
[来源:
某学生用中和滴定法测定某烧碱的纯度。实验如下:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制成1000mL的溶液,除烧杯 外,还需要的玻璃仪器有。
外,还需要的玻璃仪器有。
(2)用标准 0.1000 mol/L的盐酸溶液滴定NaOH溶液的实验操作如下:
| A.用碱式滴定管取稀NaOH溶液 20 mL,注入锥形瓶中,加入指示剂。 | B.用待测定的NaOH溶液润洗碱式滴定管。 | C.用蒸馏水洗干净滴定管。 | D.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3 cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。E.检 查滴定管是否漏水。F.另取锥形瓶,再重复操作一次。 查滴定管是否漏水。F.另取锥形瓶,再重复操作一次。 |
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
。
②该滴定操作中应选用的指示剂是: 。
(3)酸式滴定管用蒸馏水润洗后,未用标准液润洗,导致滴 定结果(填“偏小”、“偏大”或“无影响”);酸式滴定管读数时,若先俯后仰,则结果会。
定结果(填“偏小”、“偏大”或“无影响”);酸式滴定管读数时,若先俯后仰,则结果会。