相同物质的量浓度,相同体积的(NH4)2HPO4、(NH4)3PO4和NH4H2PO4三种溶液分别滴加相同物质的量浓度的NaOH溶液直至完全反应,则三种溶液耗用NaOH溶液体积之比是( )
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.6∶3∶2 |
在密闭容器中进行反应X2(g)+3Y2(g) 2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1mol/L、 0.3mol/L、0.2mol/L,达到平衡时下列物质的浓度可能为
2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1mol/L、 0.3mol/L、0.2mol/L,达到平衡时下列物质的浓度可能为
| A.X2为0.2mol/L | B.Y2为0.2mol/L |
| C.Z2为0.4mol/L | D.Y2为0.6mol/L |
下列电子式或 结构式错误的是
结构式错误的是

下列元素中,原子半径最大的是()
A.Li  |
B.Na | C.F | D.Cl |
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: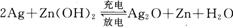
在此电池放电时,负极上发生反应的物质是
| A.Ag | B.Zn(OH)2 | C.Ag20 | D.Zn |
对于可逆反应2SO2 + O2 2SO3,在混合气中充入一定量的18O原子,达到平衡以后,18O原子
2SO3,在混合气中充入一定量的18O原子,达到平衡以后,18O原子
| A.只存在于O2中。 | B.只存在于O2和SO2中 |
C.只存在于O2和S O3中 O3中 |
D.存在于O2、SO2和SO3中 |