在标准状况下,250 mL烧瓶充满氨气后,倒置于水槽中,假设溶解后的溶质不向烧瓶外扩散,则烧瓶中氨水的物质的量浓度接近于( )
| A.1 mol·L-1 | B.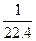 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D.0.118 mol·L-1 |
从海带中提取碘的实验过程中,涉及下列操作,其中正确的是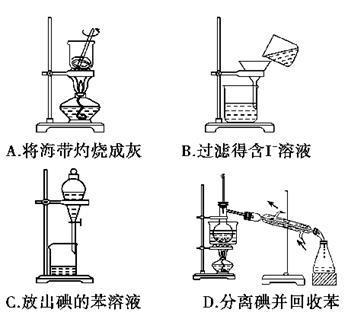
下列各反应中,氧化反应与还原反应在同种元素中进行的是
| A.Cl2+2NaOH===NaCl+NaClO+H2O |
B.2KClO3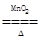 2KCl+3O2↑ 2KCl+3O2↑ |
C.2KMnO4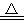 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
下列叙述中正确的是
| A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,不能说明SO2具有漂白性 |
| B.浓盐酸和浓硫酸暴露在空气中浓度都会降低,其原因相同 |
| C.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- |
| D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性 |
NA为阿伏伽德罗常数,下列说法正确的是
| A.18gD2O和18gH2O中含有的质子数均为10NA |
| B.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| C.欲配制1.00L 1.00mol·L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
三个相同的恒温恒容密闭容器中分别盛有等质量的H2、CH4、O2,下列说法正确的是
| A.三种气体的分子数目一定相等 |
| B.三种气体物质的量之比为16∶2∶1 |
| C.三种气体的密度之比为1∶2∶1 6 |
| D.三种气体的压强一定相等 |