为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品→溶解→加过量试剂A→过滤出现沉淀B→洗涤沉淀→烘干称量→处理实验数据并得出结果。
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中同学所选的试剂A不合理,理由是________________。
(2)以下都是在试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码,烧杯、过滤器、铁架台及附件,胶头滴管、量筒,其中还缺少一件必备的仪器是_____________。
②若过滤所得沉淀未经洗涤烘干称量,测得结果将________(填“偏高”或“偏低”)。
③若实验测得混合物的质量为W g,沉淀物的质量为m g,实验测定的氯化铵质量分数计算式=_____________。
某溶液中可能含有A13+、NH4+、Fe2+、CO32-、SO42-、C1-中的一种或几种,取该溶液进行以下连续实验:
(1)取溶液少量于试管中,测得溶液的pH为2,则溶液中不存在的离子是______________。
(2)继续向溶液中加入过量Ba(NO3)2溶液,有沉淀生成,同时有气体放出,写出产生气体的离子方程式。
(3)取(2)中的上层清液,加入过量NaOH溶液,有沉淀、气体生成,此沉淀和气体的化学式为、。
(4)继续向(3)中反应后的剩余溶液中通入足量CO2气体,又有白色沉淀生成,则原溶液中存在的离子是。
(5)上述实验中还不能确定是否存在的离子是。
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
_____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为。
(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。
上述装置中正极反应式为。
②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用。
| A.0.5 mol·L-1氯化亚铁溶液 | B.0.5 mol·L-1氯化铜溶液 |
| C.0.5 mol·L-1盐酸 | D.0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液 |
(3)利用提供的试剂和用品:0.1 mol·L-1盐酸溶液、0.1 mol·L-1醋酸溶液、0.5 mol·L-1氯化铝溶液、0.5 mol·L-1氢氧化钠溶液、PH试纸。
请设计最简单实验证明氢氧化铝为弱碱
I.下列四支试管中,过氧化氢分解的化学反应速率最大的是
| 试管 |
温度 |
过氧化氢浓度 |
催化剂 |
| a |
室温(25℃) |
12% |
有 |
| b |
水浴加热(50℃) |
4% |
无 |
| c |
水浴加热(50℃) |
12% |
有 |
| d |
室温(25℃) |
4% |
无 |
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。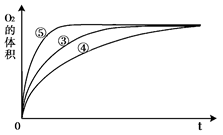
分析上图能够得出的实验结论是_________________________。
在复习元素周期律过程中,某研究性学习小组的几位同学拟通过具体的实验来探讨某些金属元素的性质差异,下面是他们设计的探究性实验方案,请填写下列空白:
(1)实验目的:比较钠、镁、铝金属性强弱。
(2)实验用品:酒精灯、、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、6 mol·L-1的盐酸
(3)实验过程与现象记录
Ⅰ.甲同学的方案如下:
| 实验过程 |
预期现象 |
实际观察到的现象 |
| a取已切去表皮的一小块金属钠,放入盛有水的某容器中 |
立即剧烈反应 |
开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞的试管中加入一小段镁条 |
有气泡产生,溶液变红色 |
没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol·L-1盐酸的试管中加入大小相同的镁片和铝片 |
镁、铝与盐酸反应产生气泡剧烈程度不同 |
镁与盐酸反应产生气泡速率较快 |
①你认为a、b两步实验中出现异常现象的可能原因是:
a;
b。
②上面的实验表明:钠、镁、铝三种元素的金属性由强到弱的顺序为。
Ⅱ乙同学的方案:他认为只需要一种试剂就可以确定钠、镁、铝的金属性强弱,预计他的主要实验操作是。
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL)。实验装置如下 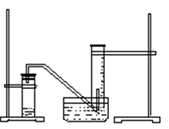
请回答:(1)进行此实验时,必须保证气密性良好,如何检验此装置的气密性?
____________________________________________________________________
(2)以下是测量收集到气体体积必须包含的几个步骤:
a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;
c.读取量筒内气体的体积。
这三个操作步骤的正确顺序是(填写代号) _____________________。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
_______________________________________________________
进行该操作的目的是___________________________________________
(4)如果实验中得到的氢气体积是VmL(已折算成标准状况),水蒸气的影响忽略不计
锌的摩尔质量的计算式为(含W、V,不必化简):M(Zn)= _______________________