化合物E(含两种元素)与NH3反应,生成化合物G和H2。化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量分数分别是40%和7.4%。由此推断:
(1)化合物G的化学式为______________________________________。
(2)反应消耗1 mol NH3,可生成2 mol H2,组成化合物E的元素是___________________和_____________________。
(3)1 mol E和2 mol NH3恰好完全反应,化合物E的化学式为_______________________。
原子是由、构成的。原子的质量主要集中在上。
完成下面表格,体会复合材料与合金的异同。
普通玻璃、普通钢和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,完成下面的表格。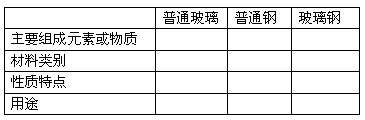
金币、银币、铜币等金属货币在我国历史上曾发挥过重要作用,其中的一些被收藏爱好者珍藏着,在一位收藏者的家中,陈列了很多金属货币。
(1)其中有些货币表面是黑色,且有少量绿色锈状物,则这肯定是___________币,黑色物质是_________,形成这种物质的化学方程式为_________________,绿色物质是_________,形成这种物质的化学方程式为_________________,若除去这些物质应选用_______________,发生反应的离子方程式__________________,充分反应后,这种金属币的真面目为________色。
(2)其中有一枚是闪闪发光的黄色金属币,它肯定是________币,表面一直未被氧化的原因是_________________。
(3)若将金币、银币、铜币分别放在稀硝酸中浸泡,能溶解的是__________,不溶解的是_______________,写出溶解时的化学方程式_________________。
某无色溶液中只含有下列8种离子中的某几种: Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-、NO3-,已知该溶液与铝反应放出氢气。试回答下列问题:
(1)若反应后生成Al3+,则溶液中可能存在的离子有_______________,一定存在的离子有________________,一定不存在的离子有_________________反应的离子方程式为________________。
(2)若反应后生成〔Al(OH)4〕-离子,则溶液中可能存在的离子有_______________,一定存在的离子有________________,一定不存在的离子有_________________反应的离子方程式为________________。