已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O 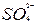 +4H++2Fe2+ +4H++2Fe2+ |
B.I2+SO2+2H2O H2SO4+2HI H2SO4+2HI |
C.H2O2+2H++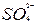  SO2+O2+2H2O SO2+O2+2H2O |
D.2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
下列表达方式正确的是()
A.碳-12原子: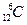 |
B.硫离子结构示意图: |
C.羟基的电子式: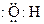 |
D.HClO的结构式:H—O—Cl |
以下性质的比较中,正确的是()
| A.原子半径:Cl>Na>O>N | B.密度:脂肪>四氯化碳>水>苯 |
| C.熔点:NaF>NaCl>CCl4>CF4 | D.热稳定性:HF>HCl> H2S > H2O |
同一主族的两种元豢的原子序数之差不可能是()
A16 B26C36D46
下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是()
| A.NH4Cl=NH3↑+ HCl↑ | B.NH3+CO2+H2O=NH4HCO3 |
| C.2NaOH+Cl2=NaCl+NaClO+H2O | D.2Na2O2+2CO2=2Na2CO3+O2 |
下列叙述中正确的是 ( )
| A.任何化学反应都能设计成原电池; |
| B.任何氧化还原反应都能设计成原电池; |
| C.原电池反应一定是氧化还原反应 |
| D.两个不同的金属电极用导线连接插入到电解质溶液中一定能形成原电池。 |