W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为__________<__________(用分子式表示)。
(3)这四种元素原子半径的大小为__________>__________>__________>__________(填元素符号)。
淡黄色固体X和气体A存在如下转化关系: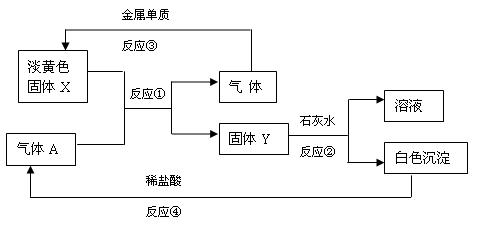
请回答下列问题:
(1)固体X的名称 A的化学式 。
(2)写出反应①③的化学方程式,并指出氧化剂。
反应① , 。
反应③ , 。
(3)写出②④反应的离子方程式:
反应② 。
反应④ 。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:;若反应过程中有2 mol电子发生转移,会有g Cu溶解。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤: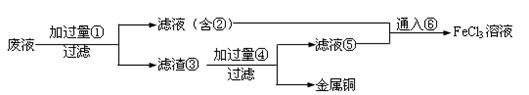
请写出上述试验过程中②③⑤的化学式:
②,③,⑤。
请写出①⑥各步反应的离子方程式:;
。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳 [Ca(OH)2] 制取漂白粉,反应的化学方程式为
。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
某溶液中含有Ba2+、Cu2+和Ag+,现用氢氧化钠、盐酸和硫酸钠溶液将三种离子逐一沉淀分离。其流程如下图所示:(其中“溶液2”为无色溶液)
回答下列问题:
(1)沉淀1 的化学式:。
的化学式:。
(2)写出下列反应的离子方程式:
溶液1 + B:。
溶液2 + C:。
C:。
实验证明,以下六种物质是氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe(SO4)3。
(1)这六种物质中,是反应物,
是生成物。
(2)该反应中,氧化剂是,体现性。
(3)若 有4mol 氧化剂参加反应,将会有mol电子发生转移。
有4mol 氧化剂参加反应,将会有mol电子发生转移。