有关苯分子中的化学键描述正确的是( )
| A.每个碳原子的sp2杂化轨道中的其中一个形成大π键 |
| B.每个碳原子的未参加杂化的2p轨道形成大π键 |
| C.碳原子的三个sp2杂化轨道与其他形成三个σ键 |
| D.碳原子的未参加杂化的2p轨道与其他形成σ键 |
下列化学用语正确的是
| A.乙烯的结构简式:CH2CH2 |
| B.次氯酸的结构式:H - Cl-O |
C.原子结构示意图: 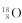 |
D.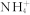 的电子式: 的电子式: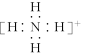 |
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
| A.“洧水”的主要成分是油脂 | B.“洧水”的主要成分是煤油 |
| C.烟的主要成分是炭黑 | D.烟的主要成分是石墨 |
下列叙述正确的是
| A.同温同压下,相同体积的物质,它们的物质的量必相同 |
| B.常温常压下,等质量的N2与CO所含分子数相同 |
| C.V L O2的质量一定比V L CO2的质量小 |
| D.A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2∶1 |
瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,则此时甲烷和氧气的体积比为
| A.1∶4 | B.1∶2 | C.2∶1 | D.1∶1 |
下列反应必须加入氧化剂才能实现的是
| A.KMnO4→K2MnO4 | B.PCl3→PCl5 | C.CO2→CO32- | D.NO3-→NO |