实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于( )
| A.由极性键构成的极性分子 |
| B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 |
| D.由非极性键构成的非极性分子 |
下列说法正确的是
| A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行 |
| B.吸热反应能自发进行的原因是从外界获得了能量 |
| C.Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性 |
| D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应 |
下列说法中,不正确的是
| A.如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等 |
| B.某吸热反应能自发进行,因此该反应是熵增反应 |
| C.白铁(镀锌)制品镀层受损后,铁制品比受损前更容易生锈 |
| D.一个化学反应的△H仅与反应的起始状态和反应的最终状态有关,与反应途径无关 |
下列说法正确的是
| A.放热反应一定能自发进行,吸热反应一定不能自发进行 |
| B.化学反应的反应热不仅与体系的始态和终态有关,也与反应的途径有关 |
| C.催化剂不仅能加快反应速率,也能增大反应物的转化率 |
| D.升高温度,能提高活化分子百分数,不能提高反应所需的活化能 |
恒温恒容条件下,进行以下反应:H2(g)+Br2(g)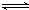 2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
| A.达平衡时HBr物质的量一定仍为a mol |
| B.两平衡压强比为3:(x+y+z) |
| C.达平衡时HBr的物质的量为(x+y+z)a/3 |
| D.x、y、z应满足的关系是 4x+z= 2y |
某温度下,H2(g)+CO2(g)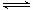 H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.反应开始时,反应速率:甲<乙<丙
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,c(CO2)丙=2c(CO2)甲
D.平衡时,乙中CO2的体积分数大于60%