试判断下列物质能否溶于水,能溶于水的组合是( )
①葡萄糖 ②己醛 ③硬脂酸 ④硬脂酸钠 ⑤硬脂酸镁 ⑥乙二酸
⑦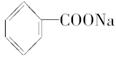 ⑧
⑧
⑨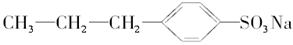
⑩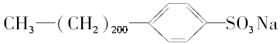
| A.①④⑥⑦⑨ | B.全溶 |
| C.除⑤⑧外全溶 | D.①④⑥⑦ |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表 ,下列说法错误的是( )
,下列说法错误的是( )
| 物质 |
X |
Y |
Z |
W |
| 初始浓度/mol·L-1 |
0.5 |
0.6 |
0 |
0 |
| 平衡浓度/mol·L-1 |
0.1 |
0.1 |
0.4 |
0.6 |
A.反应达到平衡时,X的转化率为80% B.该反应的平衡常数表达式为K=
B.该反应的平衡常数表达式为K=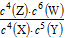
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( )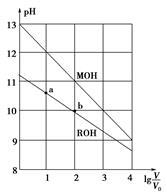
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
| D.当lg=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大 |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.由水电离的H+离子浓度等于10-12mol/L的溶液中:Na+、K+、NO3-、HCO3- |
| B.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| C.加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+ |
| D.c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+ |
下列说法正确的是( )
| A.H2(g)的燃烧热ΔH=-285.8 kJ/mol, 则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ/ mol |
| B.反应物的总能量低于生成物的总能量时,该反应为放热反应 |
| C.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s) ΔH<0 |
D.已知:298 K时,N2(g)+3H2(g)  2NH3(g) ΔH =-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5 mol H2,达到平衡时放出46.0 kJ的热量 2NH3(g) ΔH =-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5 mol H2,达到平衡时放出46.0 kJ的热量 |