某离子X2+的最外层电子排布是5s2。当把固体XCl2溶于水配制成溶液时,需加入少量的单质X和盐酸。由此判断下列说法正确的是( )
| A.X元素常见的化合价是+2和+4价 | B.X(OH)2是强碱 |
| C.XCl2溶液显酸性 | D.X元素的最高价氧化物的水化物显强酸性 |
化学广泛应用于生活生产,下列说法正确的是
| A.青铜器、硬币都属于纯净物 |
| B.葡萄糖和银氨溶液发生银镜反应可用作制镜子 |
| C.往花生油中加入稀硫酸能发生皂化反应 |
| D.鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
可逆反应2SO2(g)+O2(g) 2SO3(g)△H<0, 在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如图所示。下列说法正确的是:
2SO3(g)△H<0, 在一定条件下达到平衡状态。在t1时刻改变某一条件,化学反应速率与反应时间的关系如图所示。下列说法正确的是:
| A.维持温度、反应体系容积不变,t1时充入SO3(g) |
| B.维持压强不变,t1时升高反应体系温度 |
| C.维持温度、容积不变,t1时充入一定量Ar |
| D.维持温度、压强不变,t1时充入SO3(g) |
某澄清透明溶液中可能含有①Al3+;②Mg2+;③Fe3+;④Fe2+;⑤H+;⑥C032-⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是: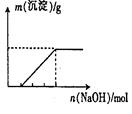
| A.②⑤⑥⑦ | B.②③⑤⑦ |
| C.①②③⑥⑦ | D.①②③④⑤⑦ |
下列表示对应化学反应的离子方程式正确的是:
| A.将过量SO2气体通入氨水中:SO2+2 NH3·H2O ="2" NH4+ + SO32-+H2O |
| B.向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| C.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3- = BaCO3↓+2H2O+ CO32- |
| D.硝酸铁溶液中滴加足量HI溶液:Fe3+ + 3NO3-+12H+ +10I- = Fe2+ + 5I2 + 3NO↑ + 6H2O |
有一反应:2A+B 2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是:
2C,其中A、B、C均为气体,右图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是: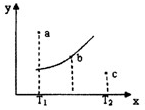
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)