在某100 mL混合溶液中,HNO3和H2SO4的物质的量浓度分别为0.400 mol·L-1和0.100 mol·L-1,向该混合溶液中加入1.92 g铜粉,加热使其充分反应,若反应前后溶液体积视作不变,反应后溶液中Cu2+的物质的量浓度为( )
| A.0.15 mol·L-1 | B.0.225 mol·L-1 |
| C.0.3 mol·L-1 | D.0.6 mol·L-1 |
下列操作中正确的是()
| A.用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl 溶液全部加热蒸干 |
| B.在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 |
| C.用25 mL量筒量取4.0 mol/L的盐酸5.62 mL |
| D.用托盘天平准确称取5.85 g NaCl固体 |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl—的物质的量之比为()
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.3∶4∶3 |
下列反应的离子方程式书写不正确的是()
| A.澄清石灰水中通入过量二氧化碳:Ca2++ 2OH-+ CO2 = CaCO3↓+ H2O |
| B.氧化亚铁溶于稀盐酸: FeO+ 2H+= Fe2++ H2O |
| C.二氧化硅与烧碱溶液反应:SiO2 +2OH-= SiO32-+ H2O |
| D.除去氧化膜的铝片插入硝酸汞溶液中:2Al+3Hg2+= 2Al3+ + 3Hg |
设NA表示阿伏加德罗常数,下列叙述中正确的是()
| A.标准状况下,2.24 L CCl4所含的原子数为0.5 NA |
| B.100 mL 0.1 mol/L的NaCl溶液中,所含微粒总数为0.02 NA |
| C.1.7 g的OH-中含有的电子数为NA |
| D.78 g Na2O2与足量水反应转移电子数为2 NA |
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是()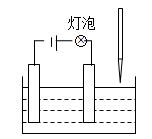
| A.盐酸中逐滴加入氢氧化钠溶液 |
| B.醋酸溶液中逐滴加入氨水溶液 |
| C.硫酸中逐滴加入氢氧化钡溶液 |
| D.盐酸中逐滴加入硝酸银溶液 |