将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况)。则所消耗硝酸的物质的量是( )
| A.0.12 mol | B.0.11 mol | C.0.09 mol | D.0.08 mol |
常温下,在c(H+)/c(OH−)=1×1012的溶液中,下列各组离子能大量共存的是
| A.Fe2+、Mg2+、NO3−、SO42− | B.Fe3+、Na+、Cl−、SCN− |
| C.NH4+、Al3+、NO3−、Cl− | D.Ca2+、K+、Cl−、HCO3− |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
下列解释事实的反应方程式正确的是
A.氨水使酚酞溶液变红:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| B.向FeCl3溶液中加入Mg(OH)2,溶液中有红褐色沉淀生成:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| C.铅蓄电池放电时的正极反应为:PbO2+2e–+4H+=Pb2++2H2O |
| D.钢铁的析氢腐蚀与吸氧腐蚀的负极电极反应相同:Fe-3e–=Fe3+ |
NOx是汽车尾气中的主要污染物之一。通过NOx传感器可监测NOx的含量,其工作原理示意图如下。下列说法正确的是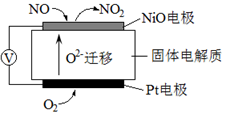
| A.Pt电极作负极,NiO电极作正极 |
| B.Pt电极上发生的是氧化反应 |
| C.NiO电极上发生的是还原反应 |
| D.NiO电极的电极反应式为NO+O2–-2e–=NO2 |
实验:①1 mol·L–1AgNO3溶液和0.1 mol·L–1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c; ②向滤液b中滴加0.1 mol·L–1KI溶液,出现浑浊; ③向沉淀c中滴加0.1 mol·L–1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+ (aq)+Cl–(aq) Ag+ (aq)+Cl–(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl 转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |