强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1) △H =-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H ="-" Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) ="=" 1/2Na2SO4(aq) +H2O(1) △H ="-" Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H ="-" Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
用容量瓶准确配制一定浓度的NaCl溶液时,下列操作会使溶液浓度偏高的是
| A.用粗盐代替NaCl固体 |
| B.定容时,溶液液面低于容量瓶刻度线 |
| C.从烧杯向容量瓶转移溶液时,有少量溶液溅出 |
| D.向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
下列有关乙酸和乙醇的叙述正确的是
| A.白醋的醋味源于乙醇 | B.米酒主要成分为乙酸 |
| C.二者均为无机物 | D.二者在一定条件下可发生反应 |
在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2 SO2+ O2 2 SO3。反应达到平衡后,各物质的物质的量可能为
2 SO3。反应达到平衡后,各物质的物质的量可能为
| n(SO2)/mol |
n(O2)/mol |
n(SO3)/mol |
|
| A |
2.0 |
1.0 |
0 |
| B |
1.0 |
0 |
1.0 |
| C |
0.20 |
0.10 |
1.80 |
| D |
0 |
0 |
2.0 |
分离提纯是化工生产中常用的方法。下列说法合理的是
| A.蒸馏自来水可得到蒸馏水 | B.酸溶法除去Al2O3的Fe2O3 |
| C.过滤法除去乙酸中的乙醇 | D.碱溶法除去Al2O3中的SiO2 |
下图是产生和收集气体的实验装置示意图,该装置适合于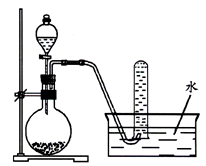
| A.用浓硝酸和Cu制取NO2 |
| B.用浓盐酸和MnO2制取Cl2 |
| C.用H2O2溶液和MnO2制取O2 |
| D.用NH4C1溶液和Ca(OH)2制取NH3 |