某课外小组在做过氧化钠与水反应的实验时,发现向反应后的溶液中滴加酚酞试液时,溶液呈现红色,但红色很快褪去。根据对实验现象的观察和思考,甲、乙、丙3位同学分别提出了自己的推测。
甲:反应时试管很热,可能是溶液温度较高使红色褪去。
乙:由于所加水较少,可能是氢氧化钠溶液浓度较大使红色褪去。
丙:过氧化钠会跟有色物质结合成不稳定的无色物质,从而使红色褪去。
(1)验证甲同学的推测是否正确的方法是:_______________________________________。
(2)验证乙同学的推测是否正确的方法是:_______________________________________。
(3)验证丙同学的推测是否正确的方法是:_______________________________________。
实验室欲配制0.05mol·L-1的NaOH溶液500mL,有以下仪器:
①烧杯② 100mL量筒 ③100mL容量瓶④胶头滴管⑤玻璃棒⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有_______________(填代号),还缺少的仪器是_______________。该实验中两次用到玻璃棒,其作用分别是_______________________,____________________。
(2)使用容量瓶前必须进行的的一步操作是____________________________________。
(3)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为_______________________(用序号填写)在①操作中需称量NaOH__________g
(4)若定容时,眼睛仰视刻度线,所得溶液的浓度 (偏高、不变、偏低)。
(5)若某学生用托盘天平称量药品时,在托盘天平左盘放有20g砝码,天平达平衡时游码的位置如图,则该同学所称量药品的质量为_____________。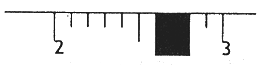
实验需要0.008mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
(1)实验中除了托盘天平、烧杯还必需要的玻璃仪器有: 。
(2)所需NaOH固体用托盘天平称量的质量为 g
(3)下列操作使所配浓度偏小的有 (填写字母)
| A.称量用了生锈的砝码; |
| B.将NaOH放在纸张上称量; |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中; |
| D.往容量瓶转移时,有少量液体溅出 |
E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度线
G、容量瓶未干燥即用来配制溶液
H、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
用质量分数为36.5%的盐酸(密度为1.16g•cm﹣3)配制1mol•L﹣1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶。
(2)计算已知盐酸的物质的量浓度为 。
(3)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
| A.5mL | B.10mL | C.25mL | D.50mL |
(4)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号) 。
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”).若用干燥洁净的量筒量取浓盐酸时俯视,则配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”)。
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐。
(1)实验室中可将FeCl3溶液 、 、过滤、洗涤干燥得FeCl3·6H2O;再 ,得到无水FeCl3。
(2)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。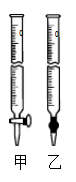
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中;下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
将提取食盐后的卤水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550 g样品溶于水,配成100 mL溶液;
②将溶液分成两等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g;
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验NaOH溶液已足量的方法是 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol·L-1可视为沉淀完全,则应保持溶液中c(OH-)≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。