将3.8 g CO和H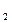 混合气体,在足量的氧气中燃烧,产物全部通过足量的Na
混合气体,在足量的氧气中燃烧,产物全部通过足量的Na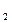 O
O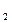 ,则Na
,则Na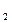 O
O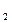 增重( )
增重( )
| A.2 g | B.38 g |
| C.5 g | D.无法计算 |
在溶液中能大量共存的一组离子或分子是
| A.NH4+ H+ NO3- HCO3- | B.K+ Al3+ SO42- NH3·H2O |
| C.Na+ K+ SO32- Cl2 | D.Na+ CH3COO- CO32- OH- |
下列类型的反应,一定发生电子转移的是【C】
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
下列反应的离子方程式书写正确的是
| A.氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O |
| B.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3―== CaCO3↓+H2O |
| C.氯化亚铁溶液中通入氯气:2Fe2++Cl2="=" 2Fe3++2Cl- |
| D.碳酸钙溶于醋酸:CaCO3+2H+==Ca2++CO2↑+H2O |
下列液体中,不会出现丁达尔效应的分散系的是① Fe(OH)3胶体②碘酒③淀粉溶液④ Al(OH)3胶体
A② B③④ C①③ D④
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
| A.2.4g金属镁变为镁离子时失去的电子数为0.1NA |
| B.1mol HCl气体中的粒子数与0.5mol·L-1盐酸中溶质粒子数相等 |
| C.在标准状况下,22.4L CH4与18g H2O所含有的分子数均为NA |
| D.22.4L的CO气体与1mol N2所含的电子数相等 |