用金属钠制取Na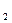 O,通常用NaNO
O,通常用NaNO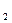 和Na反应:2NaNO
和Na反应:2NaNO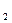 +6Na
+6Na 4Na
4Na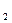 O+N
O+N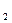 ↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
↑。试解释为什么采用这种方法制取而不用钠在氧气中燃烧的方法。
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为,1mol M中含有σ键的数目为。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是。
(3)写出与BD2互为等电子体的C3-的结构式。
(4)E+的核外电子排布式为,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为。
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池。
其电池总反应为:
V3++VO2++H2O VO2++ 2H++V2+。
VO2++ 2H++V2+。
充电过程中,H+向迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为。
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
该反应的化学平衡常数表达式为K=。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如上图所示。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件
可能是(填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为。
(12分) 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为极,该极的电极反应式是,电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)肼用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式。
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程) 。
多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受。多巴胺可用香兰素与硝基甲烷等为原料按下列路线合成。
(1)C中的含氧官能团的名称是、。
(2)反应①、④的反应类型分别为、。
(3)写出由A→M的化学方程式。
(4)写出同时满足下列条件的香兰素的一种同分异构体的结构简式。
①能与碳酸氢钠溶液反应②能与FeCl3溶液发生显色反应
③有5种不同化学环境的氢原子
(5)苯乙胺( )是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
)是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式。
(2)NaClO3的作用是。
(3)加Na2CO3调pH至5.2所得沉淀为。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是;其使用的适宜pH范围是。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是。(答一条即可)