反应4NH3(气)+5O2(气)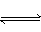 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A.v(NH3)=0.0100mol·L-1·s-1 |
| B.v(O3)=0.0010mol·L-1·s-1 |
| C.v(NO)=0.0010mol·L-1·s-1 |
| D.v(H2O)=0.045mol·L-1·s-1 |
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。则关于“暖冰”的判断正确的是
| A.“暖冰”中存在离子键 |
| B.“暖冰”中水分子的O-H键是非极性键 |
| C.“暖冰”的密度大,有导电性和导热性 |
| D.水凝固形成20℃时的“暖冰”所发生的变化是物理变化 |
与亚硝酸乙酯(C2H5—ONO)互为同分异构体的是①甘氨酸;②乙酸铵;③硝酸乙酯;④硝基乙烷
| A.①② | B.①④ | C.②③ | D.③④ |
下列微粒的表示方法能确定为氧离子的是
| A.1S22S22p6 | B. |
C. |
D. |
空气质量指数(AirQualityIndex,AQI)是定量描述空气质量状况的非线性无量纲指数。参与评价的污染物为SO2、NO2、PM10、PM2.5、O3、CO等六项。下列措施不能有效改善空气质量的是
| A.调整产业结构,淘汰落后产能 |
| B.改善能源结构,使用清洁能源 |
| C.控制工业源污染,对钢铁、水泥等行业实行限产、限污 |
| D.及时发布AQI指数,提示公众应对污染的措施 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )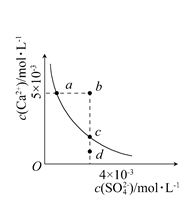
| A.在任何溶液中,c(Ca2+)、c(SO42—)均相等 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.d点溶液通过蒸发可以变到c点 |