氯气是一种重要的化工原料。工业上利用反应:3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.生成1 mol N2有6 mol电子转移 |
| D.该反应属于复分解反应 |
已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是()
| A.生成物的产量一定增大 | B.生成物的百分含量一定增大 |
| C.反应物的浓度一定降低 | D.每种反应物的转化率一定增大 |
在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为()
| A.0.34 | B.0.64 | C.0.44 | D.0.54 |
下列叙述正确的是()
| A.强电解质溶液的导电能力一定比弱电解质溶液强 |
| B.因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多 |
| C.物质的量浓度相同的磷酸钠和磷酸溶液中PO43―的物质的量浓度相同 |
| D.足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等 |
在一定温度下,密闭容器中可逆反应A(g)+3B(g) 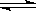 2C(g)达到平衡的标志是()
2C(g)达到平衡的标志是()
A.C的生成速率与B的反应速率相等
B.单位时间内生成n molA,同时生成3n molB
C.A、B、C的浓度不再变化
D.A、B、C的浓度之比为1:3:2
下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是()
| A.Na2SO4 | B.CH3COONa | C.NH4Cl | D.HClO |