已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) ="==" 2CO2(g)+2H2O(l) △H1= -870.3 kJ·mol-1
(2)C(s)+O2(g) ="==" CO2(g) △H2= -393.5 kJ·mol-1
(3)H2(g)+O2(g) ="== " H2O(l) △H3= -285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的焓变△H为( )kJ·mol-1
| A.488.3 | B.-244.15 | C.244.15 | D.-488.3 |
设NA为阿佛加德罗常数,下列叙述中正确的 ( )
( )
| A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA |
| B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA |
| C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA |
| D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA |
下列叙述正确的是( )
| A.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
| B.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,充分反应后,放出氢气的体积(同温同压下)相等 |
| C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中滴入Ba(OH)2溶液出现白色沉淀 |
D.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则原溶液中一定含有SO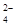 |
下列叙述正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.氯化氢溶于水能导电,但液态氯化氢不能导电 |
C.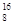 O、 O、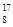 O和 O和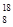 O互为同位素,均属于氧元素,且性质完全相同 O互为同位素,均属于氧元素,且性质完全相同 |
| D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多 |
下列有关颜色的变化与氧化还原反应无关的是( )
| A.浓硝酸在光照下颜色会变黄 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去 |
| C.向滴有酚酞的NaOH溶液中通入Cl2,溶液褪色 |
| D.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 |
联合国气候变化大会于2009年1 2月7日~18日在丹麦首都哥本哈根召开,焦点议题之一是发展“低碳经济”,减少温室气体排放。你认为下列做法中,不能有效减少空气中CO2含量的是( )
| A.开发利用太阳能、风能、生物能、海洋能等清洁能源 |
| B.使用节能产品,推广节能环保汽车 |
| C.植树造林,增加森林植被面积 |
| D.用脱硫处理的煤代替原煤作燃料 |