已知某种有机物A的质谱图和红外光谱图如下:

图2:红外光谱图


回答下列问题:
⑴结合以上谱图推断:有机物A的相对分子质量为 ,分子式为 ,
有机物A的核磁共振氢谱图中有 种吸收峰,峰面积之比为 ;该有机
物与氢氧化钠溶液在加热条件下反应的化学方程式为: 。
⑵直链烃B的相对分子质量比A小4,含2个甲基,并能使溴的四氯化碳溶液褪色,
写出B所有可能的结构简式:
、 。
⑶链烃C是B的同系物,且其对乙烯的相对密度为3,C的核磁共振氢谱显示:C中
只含有一种氢原子。则C在一定条件下发生聚合反应的方程式为:
。
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)
Ⅱ.某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。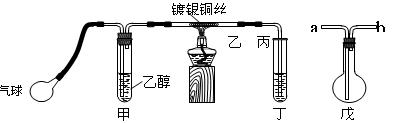
填写下列空白:
(1)甲装置常常浸在70~80℃
的水浴中,目的是。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接、__接丙。
请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)
实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下: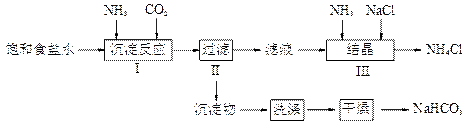
请回答:
(1)步骤I、III中需用到氨气,下列装置可用于实验室制氨气的是_________。(填序号)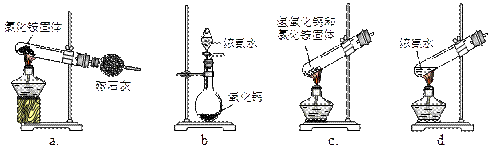
(2)写出步骤I中发生的化学反应方程式
_______________________________________________________。
若用右图装置进行该沉淀反应。实验时,须先从_____(填“a”、“b”或“c”)管通入_____气体。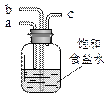
(3)步骤III向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①此处通入氨气的 作用是_________。
作用是_________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
②已知四种相关物质不同温度下的溶解度曲线如图所示。结晶时宜采用___________(填“蒸发结晶”或“降温结晶”)。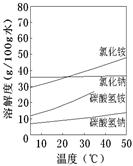
③有人设计了如下图所示的装置来验证所得的晶体中含有NH4+。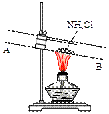
具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
(填“A”或“B”)处放置______________试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;
仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等
① _________________溶于水,加入__________________________。
②过滤、洗涤、烘干,冷却、称量,并进行_____________操作(写操作名称)。
③计算。若数据处理时将所得固体质量1.977 g错看为1.971 g,由此产生的相对误差为_____。
利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
| (1) |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| (2) |
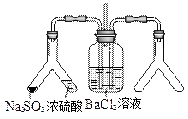 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| (3) |
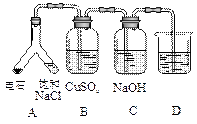 |
实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
| (4) |
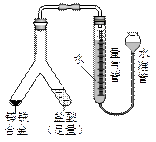 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL  ,则合金中铁的含量为________%(保留2位小数,已折算标况)。 ,则合金中铁的含量为________%(保留2位小数,已折算标况)。 |
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是
________________________________________________________。
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、冷却结晶、 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO4¯+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是 。
②计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留三位小数)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 ; 。