(1)标准状况下,用氨气做喷泉实验,实验完毕后,液体进入烧瓶总容积的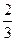 。假设溶质不外泄,则所得溶液的物质的量浓度为_________________________。
。假设溶质不外泄,则所得溶液的物质的量浓度为_________________________。
(2)标准状况下,1体积水可以溶解700体积氨气,所得溶液的密度为0.90 g·mL-1,则所得氨水的物质的量浓度为__________________。
水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提取钴的主要工艺流程如下:
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3=Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应为:MgSO4+2NaF=MgF2↓+Na2SO4 ;CaSO4+2NaF=CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10,Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 。
。
(4)“沉淀”中含杂质离子主要有SO42-、F-、和;“操作X”包括和。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为LiCoO2+C6  CoO2+LiC6,写出该电池放电时的正极反应式。
CoO2+LiC6,写出该电池放电时的正极反应式。
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下: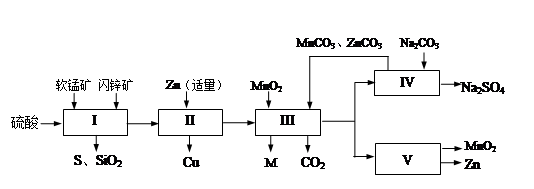
(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式:;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Zn(OH)2 |
| 开始沉淀pH |
2.3 |
4.0 |
5.6 |
| 完全沉淀pH |
4.1 |
5.2 |
8.0 |
则III中调节溶液的pH至5.2~5.4,此时生成沉淀M的成分为(写化学式),III中加入MnO2的作用是;
(3)Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水)如图,则IV中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是;
(4)V是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为;
(5)绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的主要物质有:MnO2、ZnCO3、MnCO3、和(写化学式)。
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: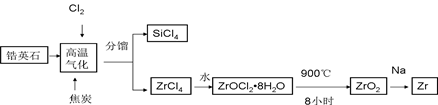
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO):;
(2)写出ZrOCl2•8H2O在900℃生成ZrO2的反应方程式;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是(单选);
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
(4)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向(填正负)极移动。电池正极电极反应为:,负极电极反应为:。
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如下图所示。
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用___________________;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是________________________;
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ•molˉ1
② 2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=-512kJ•molˉ1
则Ti(s)+2Cl2(g)= TiCl4(s)△H=;
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_______________________;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OHˉ=2CO32ˉ+6H2O,该电池中负极上的电极反应式是:2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O。则正极上发生的电极反应为:___________。工作一段时间后,测得溶液的pH是____(填“减小”、“增大”或“不变”)。
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:①CH4 (g) + H2O (g)= CO (g)+3H2 (g)△H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g)△H3="+165.0" kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为(填序号),其原因是。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO△H<0
[Cu(NH3)3]Ac·CO△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① 0<V≤44.8 L时,电池总反应方程式为;
② 44.8 L<V≤89.6 L时,负极电极反应为;
③ V="67.2" L时,溶液中离子浓度大小关系为。