在标准状况下,容积为1 L的密闭容器中刚好可以盛放a个N2分子和b个H2分子组成的混合气体,则阿伏加德罗常数的近似值可以表示为()
A.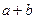 |
B.22.4(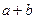 ) ) |
C.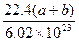 |
D.22.4(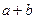 b)×6.02×10 b)×6.02×10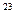 |
亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2.酸性KMnO4溶液与亚硝酸钠发生的离子反应为:MnO+NO+H+―→Mn2++NO+H2O(未配平),下列叙述错误的是( )
| A.生成1 mol Mn2+,转移电子为5 mol |
| B.该反应中氮元素被氧化 |
| C.配平后,水的化学计量数为3 |
| D.反应中氧化产物与还原产物的物质的量之比为2∶5 |
下列反应的离子方程式书写正确的是( )
| A.氯化铝溶液中加入过量氨水: Al3++4NH3·H2O===AlO+4NH+2H2O |
B.澄清石灰水与少量 苏打溶液混合: Ca2++OH-+HCO===CaCO3↓+H2O 苏打溶液混合: Ca2++OH-+HCO===CaCO3↓+H2O |
C.碳酸钙溶于醋酸: CaCO3+2H+===C a2++CO2↑+H2O a2++CO2↑+H2O |
| D.氯化亚铁溶液中通入氯气: 2Fe2++Cl2===2Fe3++2Cl- |
下列叙述正确的是( )
| A.直径介于1nm~10nm之间的微粒称为胶体 |
| B.电泳现象可证明胶体属于电解质溶液 |
| C.利用丁达尔效应可以区别溶液与胶体 |
| D.胶体粒子很小,可以透过半透膜 |
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )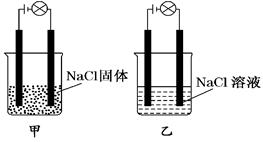
| A.NaCl是非电解质 | B.NaCl溶液是电解质 |
C.NaCl 是弱电解质 是弱电解质 |
D.NaCl在水溶液中电离出了可以自由移动的离子 |
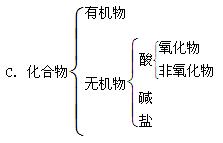
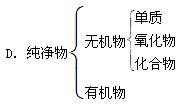
下列树状分类法正确的是( )
A.纯净物B.物质