a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为()
| A.a/4b mol-1 | B.b/4a mol-1 |
| C.a/b mol-1 | D.b/a mol-1 |
一定温度下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2 2NO+O2,此反应达到平衡的标志是
2NO+O2,此反应达到平衡的标志是
| A.单位时间内生成2nmolNO同时生成2nmolNO2 |
| B.混合气体中NO2、NO和O2的物质的量之比为2:2:1 |
| C.单位时间内生成2nmolNO同时生成nmolO2 |
| D.混合气体的颜色变浅 |
在一密闭容器中,用等物质的量的A和B发生如下反应:
A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为:()
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为:()
| A.40% | B.50% | C.60% | D.70% |
下列反应属于吸热反应的是
A.C6H12O6(葡萄糖)+6O2 6CO2+6H2O 6CO2+6H2O |
B.CH3COOK+H2O  CH3COOH+KOH CH3COOH+KOH |
C.A+B C+D; △H<0 C+D; △H<0 |
| D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量 |
可逆反应:3 A(气) 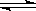 3 B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量变小,则下列判断正确的是
3 B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量变小,则下列判断正确的是
| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C可能都是液体 |
一定温度下反应:A2(g)+3 B2(g)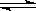 2 AB3(g)(每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g)(每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
| A.Q2 =" 2" Q1 | B.2Q1 < Q2 |
| C.Q1 < Q2 < 92.4 kJ | D.Q1 = Q2 < 92.4 kJ |