相同物质的量的各固体或液体的体积并不相同,其主要原因是()
| A.粒子大小不同 | B.粒子质量不同 |
| C.粒子间距离不同 | D.粒子间作用力不同 |
下列叙述中,正确的是
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 |
| C.向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 |
| D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
下列各组离子一定能大量共存的是
| A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B.pH试纸呈红色的溶液中:Fe2+、K+、NO3-、Na+ |
| C.水电离出的c(H+)=1×10-14mol·L-1的溶液中:Na+、Al3+、Cl-、SO42- |
| D.CO32-可以大量共存的溶液中:Ag+、K+、NO3-、Cl- |
A(g)+B(g) 2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是
2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是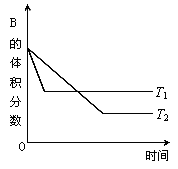
| A.T1>T2,该反应生成物的总能量高于反应物的总能量 |
| B.该反应在高温时才能自发进行 |
| C.由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 |
| D.反应从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减少 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是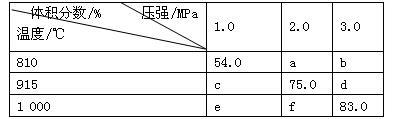
| A.该反应的△S>0 |
| B.915 ℃,2.0 MPa时E的转化率为60% |
| C.b>f |
| D.K(1000℃)>K(810℃) |
如图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是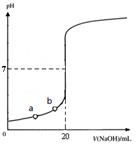
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应,溶液刚好显中性 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3 |