在标准状况下,气体A的密度为1.25 g·L-1,气体B的密度为1.875 g·L-1,A和B混合气体在相同状况下对H2的相对密度为16.8,则混合气体中A和B的体积比为( )
| A.1∶2 | B.2∶1 | C.2∶3 | D.3∶2 |
下列说法正确的是
| A.实验中需用0.20 mol·L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g |
| B.升高NH4Cl溶液温度,其水的离子积常数和pH均增大 |
| C.水比硫化氢稳定的原因是水分子间存在氢键 |
| D.在pH等于2的醋酸溶液中加入少量0.01 mol·L-1的稀盐酸,溶液的pH会变小 |
已知下列四个反应的能量与反应进程变化关系如图:
①H2SO4(aq) + 2NaOH(aq) = Na2SO4(aq) + 2H2O(l)
②CH3CH2OH(g) + 3O2(g) = 2CO2 (g)+ 3H2O(g)
③N2(g) + 3H2(g) = 2NH3(g)
④Ba(OH)2(s) + 2NH4Cl (s)= BaCl2(s) + 2NH3(g)+ 2H2O(l)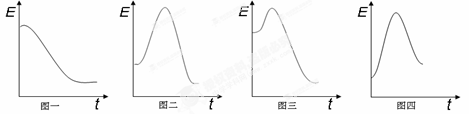
则反应②对应能量进程图可能是
| A.图一 | B.图二 | C.图三 | D.图四 |
下列离子方程式书写正确的是
A.酸性高锰酸钾与少量双氧水反应:2MnO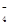 +7H2O2+6H+= 2Mn2++6O2↑+10H2O +7H2O2+6H+= 2Mn2++6O2↑+10H2O |
B.用石墨电极电解饱和MgCl2溶液:2Cl-+ 2H2O 2OH-+ Cl2↑+ H2↑ 2OH-+ Cl2↑+ H2↑ |
| C.Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++ HCO3-+OH—=MgCO3↓+H2O |
| D.向NaClO溶液中通入过量CO2;CO2+ClO—+H2O=HCO3-+HClO |
在一定条件下,A、B、C、D之间可发生如下转化关系:A+B→C+D+H2O(未配平),且该过程为非氧化还原反应,则气体C不可能是
A.NH3 B.CO2 C.SO2 D.NO2
下列说法正确的是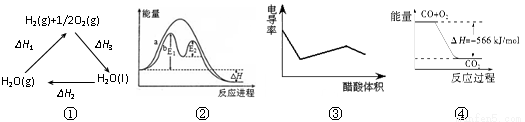
| A.图①中△H1=△H2+△H3 |
| B.图②在催化剂条件下,反应的活化能等于E1+E2 |
| C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 |
| D.图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |