某温度下,C和H2O(g)在密闭容器里发生下列反应:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
当反应达到平衡时,c(H2)="1.9" mol·L-1,c(CO)="0.1" mol·L-1。则下列叙述正确的有( )
| A.CO在平衡时转化率为10% |
| B.平衡浓度c(CO2)=c(H2) |
| C.平衡时气体平均相对分子质量约为23.3 |
| D.其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
关于化学键的下列叙述正确的是
| A.离子化合物中不可能含共价键 | B.共价化合物中可能含离子键 |
| C.离子化合物中只含离子键 | D.共价化合物中不含离子键 |
有关化石燃料的说法正确的是:
| A.化石燃料是可再生的,因此地球上的蕴藏量也是无限的 |
| B.化石燃料虽然在地球上的蕴藏量有限,但形成化石燃料的速度相当快,所以化石燃料相当于是无限的 |
| C.化石燃料的形成是非常复杂的,所需时间也较长,但化石燃料在地球上的蕴藏量是无限的 |
| D.化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生能源 |
1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子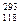 X的中子数与电子数之差为:
X的中子数与电子数之差为:
| A.0 | B.57 | C.118 | D.175 |
“即食即热型快餐”适合外出时使用,其内层是用铝箔包裹并已加工好的真包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种化学物质发生反应,放出的热量便可对食物进行加热,这两包化学物质最适合的选择是
| A.浓硫酸和水 | B.生石灰和水 | C.熟石灰和水 | D.氯化钠和水 |
C60是60个碳原子形成的封闭笼状分子,形似足球 ,它与石墨互为
,它与石墨互为
| A.同位素 | B.同素异形体 | C.同分异构体 | D.同一物质 |