在密闭容器中,X2(g)+Y2(g) 2Z(g),已知起始时,X2、Y2和Z各物质浓度分别为0.1 mol·L-1,0.3 mol·L-1和0.2 mol·L-1,反应在一定条件下达到平衡时,各物质的浓度可能是( )
2Z(g),已知起始时,X2、Y2和Z各物质浓度分别为0.1 mol·L-1,0.3 mol·L-1和0.2 mol·L-1,反应在一定条件下达到平衡时,各物质的浓度可能是( )
| A.c(Z)="0.03" mol·L-1 | B.c(Y2)="0.35" mol·L-1 |
| C.c(Y2)="0.2" mol·L-1 | D.c(Z)="0.4" mol·L-1 |
下列物质中属于强电解质且能导电的是
①氢氧化钠溶液 ②硫酸钙固体 ③铜 ④蔗糖 ⑤三氧化硫 ⑥熔融氯化钠
| A.①②⑤ | B.①②⑥ | C.③⑥ | D.⑥ |
在标准状况下,将V L A气体(摩尔质量为 M g/mol)溶于0.1 L水中,所得溶液密度为d g/cm3,则此溶液的物质的量浓度为()
A.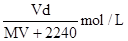 |
B.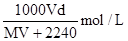 |
C.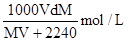 |
D.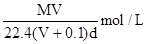 |
容量瓶上没有标记的是
| A.标线 | B.温度 | C.物质的量浓度 | D.容积 |
V L Fe2(SO4)3溶液中,含有Fe3+ m g,则溶液中SO42-的物质的量浓度为()
A.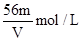 |
B.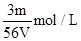 |
C.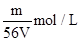 |
D.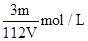 |
现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质碘的水溶液,分离以上各种混合液的正确方法是 ( )
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |