取pH均等于2的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,下列有关叙述正确的是( )
| A.醋酸与锌反应放出的H2多 |
| B.盐酸与锌反应放出的H2多 |
| C.醋酸与锌反应速率大 |
| D.盐酸和醋酸分别与锌反应的速率一样大 |
下列实验能成功的是 ( )
| A.将乙酸和乙醇混合加热制乙酸乙酯 |
| B.用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 |
| C.CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D.苯和浓溴水反应制溴苯 |
下列说法中正确的是 ( )
A.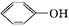 与 与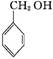 互为同系物 互为同系物 |
| B.乙醇和乙醚互为同分异构体 |
| C.可用浓溴水来区分乙醇和苯酚 |
| D.乙醇、乙二醇、丙三醇互为同系物 |
下列物质能使干燥的蓝色石蕊试纸变红又褪色的是( )
| A.氯气 | B.液氯 | C.新制氯水 | D.氯气的酒精溶液 |
下列氯化物中不能用金属和氯气直接反应制得的是( )
| A.CuCl2 | B.FeCl2 | C.MgCl2 | D.KCl |
检验SO2气体中是否混有CO2气体,可采用的方法是( )
| A.通过品红溶液 |
| B.通过盐酸,再通过BaCl2溶液 |
| C.先通过NaOH溶液,再通过澄清石灰水 |
| D.先通过酸性KMnO4溶液,再通过澄清石灰水 |