(8分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NAOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NAOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
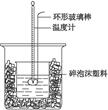
试回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是______________________________,不能用铜丝搅拌棒代替环形玻璃棒的理由是
__________________________________________________。
(2)经数据处理,t2-t1="3.4" ℃。则该实验测得的中和热ΔH=_________________________〔盐酸和NAOH溶液的密度按1 g·Cm-3计算,反应后混合溶液的比热容C按4.18 J·(g·℃)-1计算〕。
(3)若将NAOH溶液改为相同中体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_______________ΔH(填“<”“>”或“=”=,理由是:_______________
______________________________________________________________________________。
反应4NH3+5O2 4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率
4NO+6H2O在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率 (X)(表示反应物的消耗速率或生成物的生成速率)为
(X)(表示反应物的消耗速率或生成物的生成速率)为
A. (O2)=0.01 mol·L-1·s-1 (O2)=0.01 mol·L-1·s-1 |
B. (NO)=0.008 mol·L-1·s-1 (NO)=0.008 mol·L-1·s-1 |
C. (H2O)=0.003 mol·L-1·s-1 (H2O)=0.003 mol·L-1·s-1 |
D. (NH3)=0.002 mol·L-1·s-1 (NH3)=0.002 mol·L-1·s-1 |
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。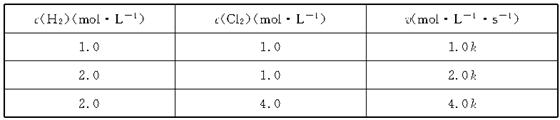
由此可推得,m、n值正确的是
| A.m=1,n="1" | B.m=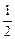 ,n= ,n=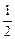 |
C.m=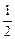 ,n="1" ,n="1" |
D.m=1,n=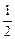 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
对某一可逆反应来说,使用催化剂的作用是
| A.提高反应物的平衡转化率 |
| B.以同样程度改变正逆反应的速率 |
| C.增大正反应速率,减小逆反应速率 |
| D.改变平衡混合物的组成 |
设C+CO2 2CO-Q1,反应速率为v1;N2+3H2
2CO-Q1,反应速率为v1;N2+3H2 2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |