某化工厂生产硫酸,某硫矿中硫单质的质量分数为88%。若取该矿石1.00 t,最多可制得98%的浓硫酸多少t?(假设生产过程中有2%的矿石损失)
将12.8 g铜跟一定量的浓硝酸反应,待铜耗尽时,共产生气体5.6 L(标准状况下)。计算被还原的HNO3的物质的量是多少?
一定量的铜与浓硝酸反应生成2.24 L NO2(标准状况下),求有多少克63%的浓硝酸中的溶质被还原。
1.92 g Cu跟适量浓HNO3反应,Cu完全反应后,共收集到气体1.12 L(标准状况),反应消耗的HNO3的物质的量是多少?
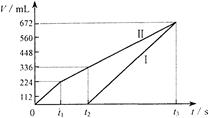 (8分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
(8分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
(1)通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
(2)实验中发现,阳极产生的气体体积与阴极相比,明显小于对应时间段的理论值。试简要分析其可能原因。
合成氨工业用氢和氮在催化剂作用下直接合成,下表表示在一定温度和压强作用下达到动态平稳时氨的含量。
达到平稳时混合气体中氨的含量(体积百分比)(氮气和氢气的体积比是1:3)
  氨含量 P(大气压) 氨含量 P(大气压)t(℃) |
100 |
200 |
300 |
600 |
1000 |
| 200 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
| 300 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
| 400 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
| 500 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
|
右图是一透热性能很好的坚固容器,活塞C可左右移动。其
总体积为44.8L,现将400℃、300大气压的氢气33.6L和400℃、