已知Cl-、I-、Fe2+、SO2和H2O2均具有还原性,它们在酸性溶液中还原性顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能进行的是( )
A.2Fe3++SO2+2H2O====2Fe2++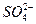 +4H+ +4H+ |
B.I2+SO2+2H2O====2H2SO4+2HI |
| C.H2O2+H2SO4====SO2↑+O2↑+2H2O | D.2Fe2++I2====2Fe3++2I- |
我国及美国、日本等国家都已研制出了一种陶瓷 柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是
柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是
| A.普通硅酸盐陶瓷 | B.氮化硅陶瓷 | C.光导纤维 | D.玻璃钢 |
当有人出现水杨酸反应(头痛、眩晕、恶心、耳鸣)时,医生可采取在静脉中注射下列哪种物质
| A.1.25%NH4Cl | B.0.9%NaHCO3 | C.75%酒精 | D.10%的青霉素 |
下列物质中,互为同分异构体的是
| A.淀粉和葡萄糖 | B.果糖和葡萄糖 |
| C.淀粉和纤维素 | D.蔗糖和纤维素 |
蛋白质发生的下列过程中,是一个可逆过程的是
| A.加入浓HNO3 | B.煮熟 | C.加入饱和的K2SO4溶液 | D.X射线照射 |
在搪瓷和陶瓷器皿具表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类为防止中毒,不能长期盛放下列物质的是
| A.食盐 | B.酱油 | C.蔗糖 | D.食醋 |