某高聚物的结构为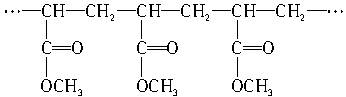
下列分析正确的是( )
| A.它是缩聚反应的产物 |
| B.其单体是CH2==CH2和HCOOCH3 |
| C.它燃烧后产生CO2和H2O的物质的量之比为4∶3 |
| D.其单体为CH2==CHCOOCH3 |
实验室里需用490mL 0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是
| A.称取7.84g硫酸铜配成500mL溶液 | B.称取12.25g胆矾配成500mL溶液 |
| C.称取12.5g胆矾配成500mL溶液 | D.称取8.0g硫酸铜,加入500mL水 |
据科学家预测,月球的土壤中吸附着数百万吨的3He,每百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是
| A.4He原子核内含有4个质子 | B.3He和4He互为同位素 |
| C.3He原子核内含有3个中子 | D.4He的最外层电子数为2,故 4He具有较强的金属性 |
已知最外层电子数相等的元素原子具有相似的化学性质。硫元素原子的核外电子分层排布示意图为,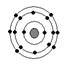 下列原子中,与硫元素原子化学性质相似的是
下列原子中,与硫元素原子化学性质相似的是
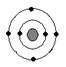
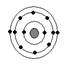

氖碳镁氧
A B C D
同温同压下,物质的量均为0.3mol的N2O(气)和NO2(气),它们的
| A.质量相同,体积不同 | B.体积相同,分子数不同 |
| C.分子数相同,质量相同 | D.体积相同,原子数相同 |
在相同温度压强下,实验室制得的下列体积的气体密度由大到小的顺序正确的是①10mL N2②20mL H2③30mL Cl2④40mL O2
| A.④③②① | B.③④①② | C.①②③④ | D.②①④③ |