据报道,1995年化学家合成了一种分子式为C200H200的含多个碳碳叁键(-C≡C-)的链状烃,其分子中含碳碳叁键最多可以是( )
| A.49个 | B.50个 | C.51个 | D.100个 |
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH-(aq)=H2O(l);△H= -57.3kJ·mol-1。已知:醋酸电离要吸热。稀醋酸、浓硫酸、稀硝酸分别与0.1mol·L-1的NaOH溶液恰好完全反应放出的热量关系如图所示。则下列描述正确的是
| A.A表示稀硝酸与NaOH溶液反应 |
| B.B表示稀醋酸与NaOH溶液反应 |
| C.b=5.73 |
| D.C表示浓硫酸与NaOH溶液反应 |
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
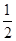 N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是
| A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 |
| B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 |
| C.厨房中常用碳酸钠溶液洗涤餐具上的油污 |
| D.可用碳酸钠与醋酸制取少量二氧化碳 |
下列离子方程式属于盐的水解,且书写正确的是
A.NaHCO3溶液:HCO3-+H2O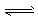 CO32-+H3O+ CO32-+H3O+ |
B.NaHS溶液:HS-+H2O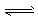 H2S+OH- H2S+OH- |
C.Na2CO3溶液:CO32-+2H2O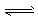 H2CO3+2OH- H2CO3+2OH- |
D.NH4Cl溶于D2O中:NH4++D2O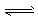 NH3·D2O+H+ NH3·D2O+H+ |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.将纯水加热到95°C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加人少量碳酸钠固体,c(H+)减小,Kw不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |