欲配制100 mL 1.0 mol·L-1 Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4溶于100 mL水中 ②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL ③将20 mL 5.0 mol·L-1 Na2SO4溶液用水稀释至100 mL
| A.①② |
| B.②③ |
| C.①③ |
| D.①②③ |
实验室用下图装置制取少量溴苯,填写下列空白。
(1)在烧瓶a中装的试剂是、、。
(2)请你推测长直导管b的作用:
一是,
二是的作用。
(3)导管c的下口出现白雾,原因是
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有生成,其离子方程式为;生成溴苯的化学反应方程式为。
(5)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体,这可能是因为的缘故。纯溴苯为无色液体,它比水______(轻或重)。获得纯净的溴苯应进行的实验操作是____________________________________________________________________
某探究小组用测量HNO3与大理石反应过程中因二氧化碳逸出质量减小的方法,研究影响反应速率的因素。限选试剂:(实验过程中不考虑稀硝酸的挥发)
1.0mol·L-1 HNO3、2.0mol·L-1 HNO3、细颗粒大理石、粗颗粒大理石、35 ℃水浴
(1)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 |
T/℃ |
大理石规格 |
HNO3浓度/mol·L-1 |
| ① |
常温 |
粗颗粒大理石 |
|
| ② |
常温 |
粗颗粒大理石 |
2.0 |
| ③ |
粗颗粒大理石 |
2.0 |
|
| ④ |
常温 |
2.0 |
以上表格中实验①、③、④空格处应填、、。
(2)整个实验中应控制的不变量是硝酸溶液体积和。
(3)该实验小组用如图实验装置进行实验。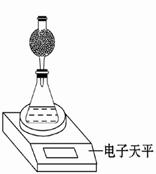
①除电子天平、干燥管、胶头滴管、秒表、玻璃棒、锥形瓶、药匙、胶塞等仪器外,必需的玻璃仪器还有。
②干燥管中应放置的试剂是。
A.碱石灰 B.无水CaCl2固体
C.生石灰D.浓硫酸
③若撤除干燥管装置,所测速率(填“偏大”、“偏小”或“不变”)。
已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。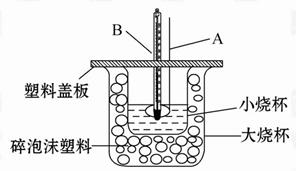
(1)仪器A的名称_______;碎泡沫塑料的作用是___________________。
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是______________。
(3)若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(4)将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。由下图可知,氢氧化钠的浓度为;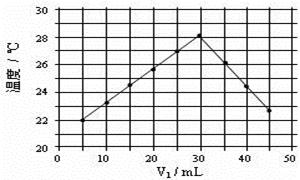
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热ΔH =(取小数点后一位)。(提示:Q=cmΔt)
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请答下面问题:
(1)B中所装试剂是,F中碱石灰的作用是。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过(填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 |
实验现象 |
实验结论 |
| ① |
溶液X中含有Na+ |
|
| ② |
溶液X中含有Cl- |
(5)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是。
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加。
Na2SiO3溶液与过量的CO2反应的离子方程式为。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 |
① |
② |
③ |
④ |
| 稀HNO3体积(mL) |
100 |
200 |
300 |
400 |
| 剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
| NO体积(L,标况) |
1.12 |
2.24 |
3.36 |
4.48 |
①实验①最先溶解的金属发生反应的化学方程式是。
②滤渣B中Fe的质量分数为____%(精确到0.1%)。