NA代表阿伏加德罗常数值,下列说法正确的是( )
| A.9 g重水所含有的电子数为5NA |
| B.1 mol MgCl2中含有的离子数为NA |
| C.7.1 g氯气与足量NaOH溶液反应转移的电子数为0.2NA |
| D.1 mol C10H22分子中共价键总数为13NA |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说 法错误的是
法错误的是
| A.电池工作时,消耗金属锌 |
| B.电池工作时,MnO2被还原为Mn2O3 |
| C.电池正极的电极反应式为2MnO2+H2O+2e-==Mn2O3+2OH- |
| D.电解质KOH溶液浓度的大小对电池反应没有影响 |
已知:①2CO(g)+ O2(g)="=" 2CO2(g)ΔH1="" -566.0kJ/mol
②C(s)+O2(g)==CO2(g)ΔH2="" -393.5kJ/mol
则1molC(s)在氧气中燃烧生成CO时的ΔH值为:
| A.+172.5 kJ/mol | B.-172.5 kJ/mol | C.+110.5kJ/mol | D.-110.5kJ/mol |
在一定条件下,下列反应达到平衡时,反应物的转化率均为a%,
① PCl5(g)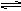 PCl3(g)+Cl2(g)② 2HI(g)
PCl3(g)+Cl2(g)② 2HI(g)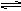 H2(g)+I2(g)
H2(g)+I2(g)
③ 2NO2(g)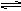 N2O4(g)
N2O4(g)
若保持各自的温度、体积不变,分别加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 | C.①增大②不变③减小 | D.①减小②不变③增大 |
下列说法或表示方法中正确的是
| A.由C(石墨,s)→C(金刚石,s);ΔH=" +2.1KJ/mol" 可知,石墨比金刚石稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
C.在101Kpa时 ,2g H2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH= +285.8KJ/mol ,2g H2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH= +285.8KJ/mol |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l);ΔH=" —57.3KJ/mol" ,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ/mol |
在恒温恒容的密闭容器里发生可逆反应: 。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
| A.2molA和1molB | B.1molA和1molB |
| C.1molA和2molB | D.1molB和1molC |