地壳中含量占第一、二位的元素之间形成的化合物不具有的性质是( )
| A.常温下与水反应生成酸 |
| B.常温下能与苛性钠反应 |
| C.高温时能与CaO、CaCO3反应 |
| D.常温时能与氢氟酸反应 |
已知Ba[Al(OH)4]2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是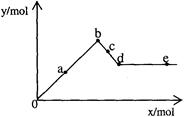
A a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B d-e时溶液中离子的物质的量:Ba2+可能等于OH-
C a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D c-d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+少
如图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨能还原氧化铁):
a. Al b.Fe2O3c.NaOH溶液 d. HI溶液 e.NH3 f.Cl2
图中⑤表示的物质是( )
| A.a或b | B.c | C.d | D.e或f |
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示。以下结论不正确的是()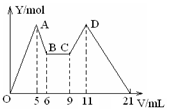
| A.从6到9,相应离子反应方程式为H++OH-=H2O |
| B.A 是NaOH,B是盐酸,且c(NaOH):c( HCl) = 2:1 |
| C.原混合液中,c(Al3+):c(Mg2+):c(Cl-) = 1:1:5 |
| D.A是盐酸,B是NaOH, 且c(NaOH) =" 2c" (HCl) |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法不正确的是 ()
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液PH不断升高
| A.①② | B.①③ | C.①④ | D.③④ |
在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g) R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
| A.P、Q、R、S的浓度相等 | B.P、Q、R、S在容器中共存 |
| C.P、Q、R、S的浓度不再变化 | D.P、Q的消耗速率相等 |