某元素的最高价氧化物的水化物的化学式为HxROy,气态氢化物的化学式为HzR。已知1mol HxROy比1molHZR的质量多64g,又知1molHxROy中R的原子核外电子总数比1molHxROy中氢原子和氧原子核外电子总数少16mol。试求R元素的原子序数、元素名称。
在标准状况下,将537.6L氯化氢气体溶于水配成2L溶液,试计算:
⑴该盐酸的物质的量浓度是多少?
⑵8.7gMnO2与100mL该盐酸反应,生成的气体在标准状况下是多少升?
⑶向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是多少?
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。则: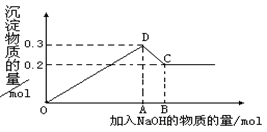
(1)写出代表各线段发生反应的离子方程式:
OD段, _________________________________,
DC段 _。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为。
(3)图中C点表示当加入mol NaOH时,Al3+已经转化为 Mg2+已经转化为。
(4)图中线段OA∶AB=。
(8分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液c(H+)= 。
(2)若a=9,则生成的气体中NO2的物质的量为mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为mL。
某有机物A有C、H、O三种元素组成,现取18g A在足量O2中充分燃烧,将燃烧产物全部依次通过无水氯化钙和碱石灰后,固体质量的增加依次为10.8g和26.4g,
求:
(1)A的最简式是 。
(2)若常温下A是气体,则A的结构式是 。
(3)若0.1molA含4.8g氧,A在浓硫酸作用下能生成六元环状化合物,写出该反应的化学方程式 。
化学上常用燃烧法确定有机物的组成。若准确称取0.54 g某有机物样品(烃或烃的含氧衍生物)。经充分燃烧后,依次通入浓硫酸和碱石灰,分别增重0.54g、1.76g。
(1)求该有机物的实验式?
(2)已知其蒸气密度为同条件下H2的27倍,求该有机物的化学式?
(3)若该化合物与Br2以1:1加成反应可产生两种互为同分异构体的有机物。请写出该化合物结构简式。