四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构。若m>n,则对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
| A.②③ | B.③ | C.①②③④ | D.①②③ |
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是 ( )
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
设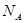 为阿伏伽德罗常数的值,下列叙述正确的是 ( )
为阿伏伽德罗常数的值,下列叙述正确的是 ( )
A.标准状态下,33.6L氟化氢中含有氟原子的数目为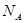 |
B.常温常压下,7.0g乙烯与丙稀的混合物共含有氢原子的数目为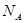 |
C.50mL 18.4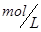 浓硫酸与足量铜微热反应,生成 浓硫酸与足量铜微热反应,生成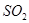 分子的数目为0.46 分子的数目为0.46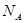 。 。 |
D.某密闭容器盛有0.1mol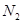 和0.3mol 和0.3mol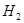 ,在一定条件下充分反应,转移电子的数目为0.6 ,在一定条件下充分反应,转移电子的数目为0.6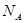 |
下列表示对应化学反应的离子方程式正确的是
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
下列离子或分子在溶液中能大量共存,通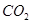 后仍能大量共存的一组是
后仍能大量共存的一组是
A. |
B.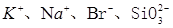 |
C. |
D.K+、Ag+、NH3*H2O、NO3- |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
| A.H2O2 | B.IO3- | C.MnO4- | D.HNO2 |