aXn-和bYm+是由短周期元素形成的简单离子,已知Xn-比Ym+多两个电子层,下列说法正确的是( )
| A.X只能是第3周期元素 | B.Y不可能是第2周期元素 |
| C.b≤4 | D.a-b+m+n等于10或20 |
下列四种化合物经过催化加氢反应后,得不到2-甲基戊烷的是
关于实验室制备乙烯的实验,下列说法正确的是()
| A.反应物是乙醇和过量的3mol/L硫酸的混合物 |
| B.温度计插入反应液面下,控制温度为140℃ |
| C.反应容器(烧瓶)中应加入少许碎瓷片 |
| D.反应完毕先熄灭酒精灯,再从水中取出导管 |
下列各组混合气体中,比乙烯含碳量高的是
| A.甲烷和丙烯 | B.乙烷和丁烯 | C.丙烷与丙烯 | D.丙烯与丙炔 |
用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为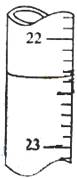
| A.22.30mL | B.22.35mL | C.23.65mL | D.23.70mL |
可逆反应2SO2(g)+O2(g) 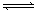 2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小是
2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小是
| A. v正>v逆 | B. v正< v逆 | C.v正=v逆 |
D.不能确定 |