下表是元素周期表的一部分,针对表中的①—⑩种元素,填写下列空白。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,化学性质最不活泼的是___________(填元素符号),这种元素的原子结构示意图为___________。
(2)用电子式表示元素⑦的单质分子的形成过程:______________________。
(3)在非金属元素的最高价氧化物对应水化物中,酸性最强的化合物是___________(填化学式,下同),在金属元素的氧化物对应水化物中,碱性最强的化合物是___________,具有两性的化合物是___________。
(4)地壳中含量最多的元素是___________(填元素符号),空气中含量最多的元素是___________(填元素符号),常温下呈液态的非金属单质是___________(填化学式)。
(5)元素③的氢化物的化学式为______________________;元素③的氢化物分别跟元素⑦、元素⑨的单质反应的化学方程式分别为______________________、______________________。
(1)向饱和Na2CO3溶液中通入CO2,现象是,原因是
①;②;③。
(2)明矾在水溶液中的电离方程式为:,实验室中若用明矾来制取Al(OH)3,则发生反应的离子方程式为:。
(5分) (1)配平下列反应方程式并用双线桥标出电子转移的方向和数目
As2O3 +HNO3 +H2O =H3AsO4 +NO↑
(2)该反应中氧化剂是________,氧化产物是_________,当有1mol As2O3参加反应时转移电子的数目为
(14 分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
①A 点时剩余固体的成分是(填化学式)。B 点时剩余固体的成分是(填化学式)
②从开始加热到 750K时总反应方程式为。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为mol·L-1。
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。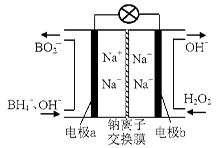
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为:;
以MnO2做正极材料,可能是因为。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g)△H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g)△H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H=。
(3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。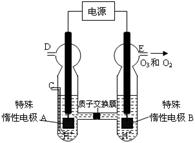
②图中阴极为(填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为:。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为(忽略O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
(10 分)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g)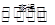 Si3N4(s) + 12HCl(g)△H<0
Si3N4(s) + 12HCl(g)△H<0
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了1.40g,则SiCl4的平均反应速率为;该反应的平衡常数表达式为。
(2)上述反应达到平衡后,下列说法正确的是
a.其他条件不变,温度升高,平衡常数K减小
b.其他条件不变,压强增大,平衡向正反应方向移动
c.其他条件不变,增大SiCl4物质的量,平衡向正反应方向移动
d.其他条件不变,增大Si3N4物质的量,平衡向逆反应方向移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
a.v逆(N2)=3v正(H2) b.v正(HCl)=4v逆(SiCl4)
c.混合气体密度保持不变d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新德平衡时,H2和HCl的物质的量之比m/n(填“>”“=”或“<”)